У цьому методі порівнюють ступеня окислення атомів у вихідних і кінцевих речовинах, керуючись правилом: число електронів, відданих відновником, повинно дорівнювати числу електронів, приєднаних окислювачем. Для складання рівняння треба знати формули реагуючих речовин і продуктів реакції. Останні визначаються або досвідченим шляхом, або на основі відомих властивостей елементів. Розглянемо застосування цього методу на прикладах.
Приклад 1. Складання рівняння реакції міді з розчином нітрату паладію (II). Запишемо формули вихідних і кінцевих речовин реакції і покажемо зміни ступенів окислення:
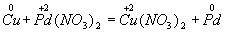
Мідь, утворюючи іон міді, віддає два електрони, її ступінь окислення підвищується від 0 до +2. Мідь - відновник. Іон паладію, приєднуючи два електрона, змінює ступінь окислення від +2 до 0. Нітрат паладію (II) -окіслітель. Ці зміни можна висловити електронними рівняннями
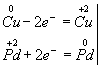
з яких випливає, що при відновників та окисників коефіцієнти рівні 1. Остаточне рівняння реакції:
Як видно, в сумарному рівнянні реакції електрони не фігурують.
Щоб перевірити правильність складеного рівняння, підраховуємо число атомів кожного елемента в його правій і лівій частинах. Наприклад, в правій частині 6 атомів кисню, в лівій також 6 атомів; паладію 1 і 1; міді теж 1 і 1. Отже, рівняння складено правильно.
Переписуємо це рівняння в іонної формі:
Cu + Pd 2+ + 2NO3 - = Cu 2+ + 2NO3 - + Р d
І після скорочення однакових іонів отримаємо
Cu + Pd 2+ = Cu 2+ + Pd
Приклад 2. Складання рівняння реакції взаємодії оксиду марганцю (IV) з концентрованою соляною кислотою (за допомогою цієї реакції в лабораторних умовах отримують хлор).
Запишемо формули вихідних і кінцевих речовин реакції:
Покажемо зміна ступенів окислення атомів до і після реакції:
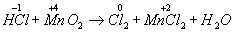
Ця реакція окислювально-відновна, так як змінюються ступені окислення атомів хлору і марганцю. НCl - відновник, MnО2 - окислювач. Складаємо електронні рівняння:
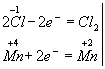
і знаходимо коефіцієнти при відновників та окисників. Вони відповідно рівні 2 і 1. Коефіцієнт 2 (а не 1) ставиться тому, що 2 атома хлору зі ступенем окислення -1 віддають 2 електрони. Цей коефіцієнт вже стоїть в електронному рівнянні:
Знаходимо коефіцієнти для інших реагуючих речовин. З електронних рівнянь видно, що на 2 моль HCl доводиться 1 моль Mn Про2. Однак, з огляду на, що для зв'язування утворюється двозарядний іона марганцю потрібно ще 2 моль кислоти, перед відновником слід поставити коефіцієнт 4. Тоді води вийде 2 моль. Остаточне рівняння має вигляд
Перевірку правильності написання рівняння можна обмежити підрахунком числа атомів одного будь-якого елементу, наприклад хлору: в лівій частині 4 і в правій 2 + 2 = 4.
Оскільки в методі електронного балансу зображуються рівняння реакцій в молекулярній формі, то після складання і перевірки їх слід написати в іонної формі.
Перепишемо складене рівняння в іонної формі:
4Н + + 4С l - + МnО2 = С l 2 + Мn 2 + + 2С l - + 2Н2Про
і після скорочення однакових іонів в обох частинах рівняння отримаємо
4Н + + 2Cl - + Mn O 2 = С l 2 + Mn 2+ + 2Н2Про
Приклад 3. Складання рівняння реакції взаємодії сірководню з підкисленим розчином перманганату калію.
Напишемо схему реакції - формули вихідних і отриманих речовин:
Потім покажемо зміна ступенів окислення атомів до і після реакції:
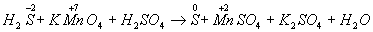
Змінюються ступеня окислення у атомів сірки і марганцю (Н2 S - відновник, КМ n Про4 - окислювач). Складаємо електронні рівняння, тобто зображуємо процеси віддачі та приєднання електронів:
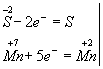
І нарешті, знаходимо коефіцієнти при окисник і відновник, а потім при інших реагують речовинах. З електронних рівнянь видно, що треба взяти 5 моль Н2 S і 2 моль КМ n Про4, тоді отримаємо 5 моль атомів S і 2 моль МnSО4. Крім того, з зіставлення атомів в лівій і правій частинах рівняння, знайдемо, що утворюється також 1 моль К2 S Про4 і 8 моль води. Остаточне рівняння реакції матиме вигляд
Правильність написання рівняння підтверджується підрахунком атомів одного елемента, наприклад кисню; в лівій частині їх 2. 4 + 3. 4 = 20 і в правій частині 2. 4 + 4 + 8 = 20.
Переписуємо рівняння в іонної формі:
5Н2S + 2 MnO 4 - + 6 H + = 5 S + 2Мn 2+ + 8Н2Про
Відомо, що правильно написане рівняння реакції є виразом закону збереження маси речовин. Тому число одних і тих самих атомів у вихідних речовинах і продуктах реакції повинно бути однаковим. Повинні зберігатися і заряди. Сума зарядів вихідних речовин завжди повинна дорівнювати сумі зарядів продуктів реакції.
Содержание
Вивчення електронного балансу на уроках хімії
розділи: хімія
Уміння складати електронний баланс при вивченні окислювально-відновних реакцій є одним з найважливіших при вивченні хімії. Однак, незважаючи на те, що вчителі приділяють багато часу і уваги формуванню цього вміння, учні відчувають труднощі і допускають численні помилки.
До типових помилок в традиційних способах призводять: неясність того, чи потрібно враховувати індекс елемента і з якої частини рівняння починати розстановку коефіцієнтів. Матеріал, що викладає нижче спосіб цих недоліків позбавлений, досить лише запам'ятати деякі вельми нескладні правила складання балансу.
З основами цього способу я познайомилася в студентські роки на лекціях і заняттях кандидата хімічних наук, викладача методики вивчення хімії Андрієнко Антоніни Леонтіївни в Астраханському педагогічному інституті ім. С.М.Кірова (нині Астраханський державний університет).
Застосовуючи цей метод протягом багатьох років у своїй роботі, мені вдалося доповнити і розширити його, поступово склалися «Правила складання балансу». Метод застосовується викладачами в ряді шкіл м Астрахані і Астраханської державної медичної академії, апробований багаторічною практикою, яка свідчить, що учні засвоюють його легше звичайного і роблять менше помилок.
суть методу: Електронний баланс складається під рівнянням, при цьому враховуються індекси елементів, потім знаходиться найменше спільне кратне для чисел відданих і прийнятих електронів (НОК), розподілом НОК на ці числа отримуємо коефіцієнти для відновлення і окислювача.
Наприклад, для рівняння Al 0 + Сl2 0 -> Al + 3Cl3 -1 міркування ведеться на один атом елемента: до реакції атом алюмінію мав ступінь окислення нуль, після реакції придбав ступінь окислення +3, отже, атом Al віддає три електрони. У тій частині рівняння, де складається баланс, індекс Al дорівнює одиниці, тому число три залишається без змін і підписується під алюмінієм:
Хлор до реакції мав ступінь окислення нуль, після реакції має ступінь окислення -1, тобто один атом хлору приймає один електрон, проте, в тій частині рівняння, де складається баланс у хлору індекс два і, множачи число електронів на індекс, отримуємо цифру два для хлору
Знаходимо НОК для числа відданих і прийнятих електронів
Розподілом НОК на число відданих електронів, отримуємо коефіцієнт для Al (6: 3 = 2)
Розподілом НОК на число прийнятих електронів, отримуємо коефіцієнт для хлору (6: 2 = 3)
В іншій частині рівняння коефіцієнти розставляються методом підбору.
Що таке схема електронного балансу?
Дано завдання: «За даними схемами складіть схеми електронного балансу». Як його виконати? Що для цього потрібно? Спробуємо розібратися разом.

Для початку зупинимося на тому, що являє собою даний метод. Якщо схема електронного балансу складена правильно, можна поставити в запропонованій реакції все стереохимические коефіцієнти.
Суть даної методики полягає у визначенні ступенів окислення окремих елементів, які брали участь у реакції. Якщо в лівій і правій частинах рівняння у елемента зберігається постійна ступінь окислення, то схема електронного балансу складається без нього.
У елементів, які поміняли свою ступінь окислення в процесі взаємодії, отримані значення враховуються при обчисленнях найменшого спільного кратного.

Для початку вам доведеться поставити у кожного елемента його ступеня окислення, користуючись певними правилами. Якщо у взаємодію вступало проста речовина, то воно не приймає, а також не віддає іншому елементу електрони, отже, його ступінь окислення дорівнює нулю. Прикладами сполук з нульовим ступенем окислення є молекули галогенів, метали.
У бінарному з'єднанні у другого елементу ступінь окислення має негативне, а у першого - позитивне значення. В сумі (з урахуванням числа атомів) повинен вийти нуль. В оксиді кальцію, наприклад, у першого елемента ступінь окислення +2, а у другого (кисню) -2. Сумарне значення дорівнює нулю, так як молекула нейтральна.
Якщо необхідно розставити ступеня окислення в більш складному речовині, то спочатку визначають показники у першого і останнього елементів. Потім, користуючись математичними обчисленнями, визначають ступінь окислення у центральний елемент. Сума всіх показників повинна бути дорівнює нулю.

Як же складається схема електронного балансу? У лівій її частині записують разом зі ступенями окислення елементи, які брали участь в окислювально-відновному процесі.
Далі знаками «плюс» і «мінус» вказується кількість прийнятих і відданих електронів в ході хімічної взаємодії. Між числом електронів визначається найменше спільне кратне. Нагадаємо, що під ним мається на увазі позитивне число, яке буде без залишку ділитися на обидві цифри, що стосуються електронів.
Схема електронного балансу вважається повною в тому випадку, коли в ній визначені і коефіцієнти. Як їх знайти? Найменше спільне кратне необхідно розділити на прийняті і віддані в процесі електрони. Отримані цифри і будуть стереохімічні коефіцієнтами.
Важливо також визначити відновник і окислювач, а також протікають при взаємодії процеси (окислення і відновлення). Отримана схема електронного балансу окисно-відновного процесу дозволить вам розставити відсутні коефіцієнти в реакції.
Завдання на ОВР в підсумковій атестації
На підставі даного методу випускникам пропонується виконання завдання з рівня «С». Успішність залежить від рівня практичних навичок учня, ступеня володіння теоретичними основами.
Наприклад, в завданні сказано: за даними схемами складіть схеми електронного балансу. Крім того, частина реагуючих речовин, а також деякі продукти взаємодії можуть бути втрачені. Дане питання вважається завданням підвищеної складності, тому передбачає певну послідовність міркувань.
Для початку у всіх елементів у відомих речовинах визначають ступеня окислення, потім записують речовини, яких не вистачає в обох частинах реакції.
Далі складається баланс. За отриманою схемою реакції розставте коефіцієнти методом електронного балансу, як було описано вище. Останньою дією буде вказівка всіх процесів, що протікають.
У тестах ЗНО з хімії передбачається окремий запис речовин, які безпосередньо беруть участь в рівнянні, з подальшою вказівкою окислювача і відновника.
Такий метод є далеко не єдиним способом розстановки коефіцієнтів у рівнянні. Можна скористатися і методом напівреакцій, який дозволяє зрівнювати відразу все речовини, записані в рівнянні.

